

我院卫林课题组在ACS Nano发表研究成果
时间:2024-07-16
来源: 生命科学学院
2024年7月16日,生命科学学院院卫林教授课题组联合松山湖材料实验室元冰研究员课题组和苏州大学杨恺教授课题组在国际权威期刊ACS Nano(IF=15.8)在线发表题为“Assembly-Induced Membrane Selectivity of Artificial Model Peptides through Entropy-Enthalpy Competition”的研究成果。
分枝杆菌噬菌体编码了一系列生物活性分子来侵染并裂解结核分枝杆菌,包括活性多肽和蛋白。目前大多数的研究都聚焦在分枝杆菌噬菌体内溶素(endolysin)蛋白,但对分枝杆菌噬菌体多肽知之甚少。我们前期从分枝杆菌噬菌体基因组编码的一系列未知功能的多肽中鉴定到分枝杆菌噬菌体来源的小分子抗结核分枝杆菌多肽PK34(FASEB J,2013,第一作者)和AK15(JBC,2019,通讯作者)。前期研究发现芳香族氨基酸残基和携带正电荷的氨基酸残基是分枝杆菌噬菌体来源的小分子多肽抑制结核分枝杆菌的关键结构元件。
在前期研究基础上,研究团队通过基于机器学习和专家知识相结合的抗菌活性相关性分析,建立了一种“AI——人类专家协商”的小分子抗结核杆菌多肽设计策略,并结合“最小模型多肽”,成功实现了多肽设计空间从20n到n的降维(n为多肽序列长度),从头设计得到了一系列基于带正电的极性赖氨酸K和疏水色氨酸W的短肽(n=13),对结核分枝杆菌的抗菌实验研究表明,K7W6在其中表现出最强的抗菌活性(图1)。
分枝杆菌噬菌体编码了一系列生物活性分子来侵染并裂解结核分枝杆菌,包括活性多肽和蛋白。目前大多数的研究都聚焦在分枝杆菌噬菌体内溶素(endolysin)蛋白,但对分枝杆菌噬菌体多肽知之甚少。我们前期从分枝杆菌噬菌体基因组编码的一系列未知功能的多肽中鉴定到分枝杆菌噬菌体来源的小分子抗结核分枝杆菌多肽PK34(FASEB J,2013,第一作者)和AK15(JBC,2019,通讯作者)。前期研究发现芳香族氨基酸残基和携带正电荷的氨基酸残基是分枝杆菌噬菌体来源的小分子多肽抑制结核分枝杆菌的关键结构元件。
在前期研究基础上,研究团队通过基于机器学习和专家知识相结合的抗菌活性相关性分析,建立了一种“AI——人类专家协商”的小分子抗结核杆菌多肽设计策略,并结合“最小模型多肽”,成功实现了多肽设计空间从20n到n的降维(n为多肽序列长度),从头设计得到了一系列基于带正电的极性赖氨酸K和疏水色氨酸W的短肽(n=13),对结核分枝杆菌的抗菌实验研究表明,K7W6在其中表现出最强的抗菌活性(图1)。
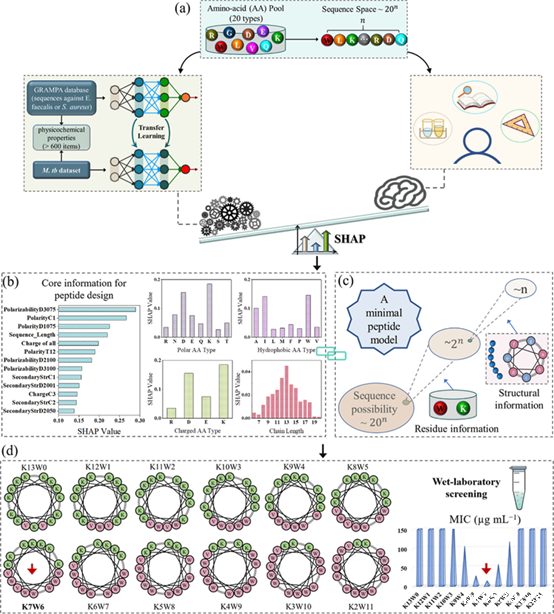
图1. “AI——人类专家协商”的小分子抗结核分枝杆菌多肽设计策略
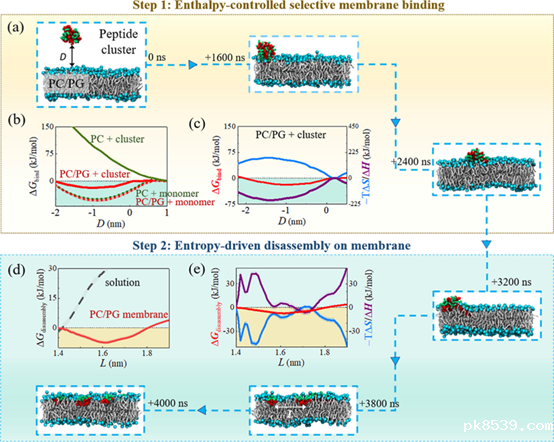
图2. 熵焓调控下的K7W6两步作用机制
扫码关注


